¡Increíble! Así funciona el nuevo medicamento que ralentiza el Alzheimer
La FDA de Estados Unidos aprobó el medicamento desarrollado por la empresa farmacéutica Eli Lilly
Una de las enfermedades más temidas por las personas adultas mayores de 65 años es el Alzheimer, padecida por más de seis millones de personas tan sólo en los Estados Unidos, y alrededor de 60 millones en todo el mundo.
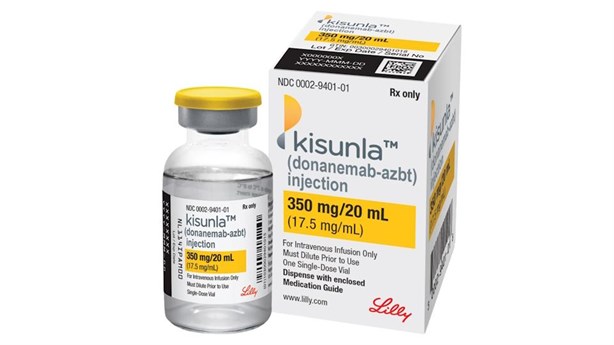
A lo largo de los años, se han tratado de producir medicamentos que combatan esta enfermedad, y el día de hoy, la Administración de Alimentos y Fármacos de Estados Unidos (FDA por sus siglas en inglés) aprobó la distribución de uno desarrollado por la empresa farmacéutica Eli Lilly, que será comercializado por la marca Kisunla.
El fármaco recibió el nombre de Donanemab, y se convierte en la segunda terapia diseñada para retrasar la progresión del Alzheimer, tras haberse aprobado hace un año su ahora fármaco rival, el Leqembi.
¿Cómo funciona el nuevo medicamento contra el Alzheimer?
Donanemab está diseñado para eliminar del cerebro la proteína beta amiloide, relacionada directamente con el Alzheimer, ideal para combatir la enfermedad en su fase inicial.
El fármaco no es una cura definitiva, pero sí retrasa enormemente la progresión del Alzheimer; sus últimas pruebas demostraron que la rapidez en el desarrollo de problemas de memoria y pensamiento se redujo en un 30% a comparación de en el uso de placebos.
Otro de sus beneficios es que permite a los pacientes suspender el tratamiento una vez que ya no hay rastro de placas amiloides en sus escáneres cerebrales, a diferencia de la terapia crónica del Leqembi, facilitándoles el llevar una vida normal durante más tiempo.

- Producto de esta dosis finita, el precio que tendrá el Donanemab será ligeramente superior al de su fármaco rival, ubicándose en 695 dólares por vial, o 32 mil dólares por un año de tratamiento.
¿Tiene efectos adversos?
Durante la última etapa de pruebas en junio de este año, también se presentaron casos de efectos adversos graves, pero poco frecuentes. La tasa de mortalidad de los pacientes aumentó en un 2% a comparación del uso de placebos, y una tercera parte de ellos presentaron hemorragias cerebrales, así como inflamaciones en una cuarta parte.
La FDA otorgó al fármaco la advertencia de seguridad más alta en su prescripción debido a los riesgos de inflamación y hemorragia cerebral potencialmente peligrosos, pero fue aprobado por unanimidad por expertos debido a que “los beneficios superaban los riesgos”.
¿Qué opinas?

- Lo último
- Lo más leído
Periódico digital en tiempo real con información preferentemente del Estado de Veracruz México